Контроль еволюції: Нобелівська премія з хімії 2019
Контроль еволюції: Нобелівська премія з хімії 2019
25 липня 2024 року

2019 рік став революційним у галузі хімії, оскільки Шведська королівська академія наук присудила Нобелівську премію з хімії 2018 трьом блискучим хімікам (рис. 1): доктору Френсіс Х. Арнольд — «за спрямовану еволюцію ферментів» ; Доктор Джордж П. Сміт і сер Грегорі П. Вінтер (спільно)— «за фаговий дисплей пептидів і антитіл». Їхній феноменальний внесок у контроль еволюції ферментів і зв’язуючих білків і їх використання на благо людства здійснив революцію як у промисловості, так і в наукових колах за останні кілька десятиліть.
Доктор Френсіс Гамільтон Арнольд зараз є професором хімічної інженерії, біоінженерії та біохімії Лінуса Полінга в Каліфорнійському технологічному інституті, Пасадена, Каліфорнія, США. Вона отримала ступінь бакалавра машинобудування та аерокосмічної інженерії в Прінстонському університеті в 1979 році, де її дослідження були спрямовані на сонячну енергію. Після закінчення навчання вона працювала інженером у різних країнах і в Інституті досліджень сонячної енергії в Колорадо, перш ніж приєднатися до Каліфорнійського університету Берклі, Каліфорнія, США, щоб отримати ступінь доктора філософії. в хімічній інженерії. Після закінчення докторантури в 1986 році вона приєдналася до Каліфорнійського технологічного інституту в якості доцента.
Під час своєї професорської кар’єри вона започаткувала «спрямовану еволюцію ферментів», яка використовує принципи еволюції для створення білків шляхом генної мутації та штучного відбору для створення вдосконалених біокаталізаторів, які можуть вирішити кілька основних глобальних проблем у сільському господарстві, сталий енергетиці. , і охорона здоров'я. Вона також є співавтором 60 патентів і співзасновником Gevo, Inc., компанії, що виробляє відновлювані хімікати та сучасне біопаливо. Окрім престижної Нобелівської премії, д-р Арнольд є лауреатом численних нагород, зокрема Премії Саклера за дослідження конвергенції (2017), Премії тисячоліття в галузі технологій (2016), Національної медалі за технології та інновації (2013) та премії NAE Чарльза Премія Старка Дрейпера (2011) серед багатьох інших. Вона була обрана до престижних членів усіх трьох Національних академій науки, медицини та інженерії США.
Доктор Джордж Пірсон Сміт зараз є почесним професором біологічних наук кураторів Університету Міссурі, Колумбія, Миссурі, США. Отримав ступінь бакалавра в Haverford College, Haverford, PA, США. Після роботи вчителем він отримав ступінь доктора бактеріології та імунології в 1970 році в Гарвардському університеті. Після докторських досліджень в Університеті Вісконсіна, Медісон, штат Вісконсин, США, він приєднався до Університету Міссурі як викладач у 1975 році. Під час творчої відпустки в Університеті Дьюка з 1983 по 1984 рік він придумав використовувати простий процес називається «фаговим дисплеєм», щоб ідентифікувати невідомий ген для відомого білка, за що він отримав Нобелівську премію з хімії в 2018 році.
Використовуючи концепцію Сміта про фаговий дисплей, інший вчений, сер Грегорі Пол Вінтер, розробив спрямовану еволюцію антитіл, які може зв'язуватися зі специфічним білком, пов'язаним, наприклад, із захворюванням людини. Сер Грегорі Пол Вінтер закінчив Трініті-коледж, Кембридж, Великобританія, у 1973 році. Він отримав ступінь доктора філософії. ступінь у 1977 році в Лабораторії молекулярної біології MRC, Кембридж, за дослідження амінокислотної послідовності триптофаніл тРНК синтетази з бактерії Bacillus stearothermophilus. Вінтер завершив свою докторську роботу в Імперському коледжі Лондона, Лондон, Великобританія, та в Інституті генетики Кембриджського університету. Значна частина його дослідницької кар’єри була повністю заснована на Лабораторії молекулярної біології MRC і Центрі білкової інженерії MRC, Кембридж. Його дослідження білкової та генетичної інженерії призвели до успішних відокремлених компаній, зокрема Cambridge Antibody Technology (придбана AstraZeneca), Domantis (придбана GlaxoSmithKline) і Bicycle Therapeutics.
Спрямована еволюція ферментів: переписування коду життя
Протягом мільярдів років наша планета Земля була здатна підтримувати численні живі організми завдяки процесу, який називається еволюцією. Еволюція привела до того, що організми здатні виживати в суворих умовах за рахунок мутації свого генетичного коду та усунення свого слабшого потомства шляхом природного відбору. Арнольд адаптувала цю концепцію природної еволюції та блискуче відтворила процедуру у своїй лабораторії для штучного контролю та прискорення процесу еволюції ферментів. Ці «фантастичні біокаталізатори» пропонують екологічно чисту альтернативу шкідливим хімічним каталізаторам і були практично впроваджені в різних галузях промисловості протягом останніх двох десятиліть.
Ферменти – це складні молекули, що складаються з тисяч комбінацій амінокислот. Початковий підхід Арнольда до відновлення ферментів з новими властивостями виявився надзвичайно складним через їх величезну кількість. Натомість Арнольд вдався до розумної ідеї створити випадкову мутацію в генетичному коді певного ферменту та ввести ці мутовані гени в бактерії, які виробляли різні різновиди цього ферменту з мутаціями. Потім ці різні сорти перевіряли на бажані властивості. Вибираються (подібно до принципу природного відбору) ті ферменти, які більш ефективно каталізують бажану хімічну реакцію, і піддаються новим випадковим мутаціям. Після кількох ітерацій бажана ефективність досягається. Весь робочий процес спрямованої еволюції ферментів продемонстровано на малюнку 2.
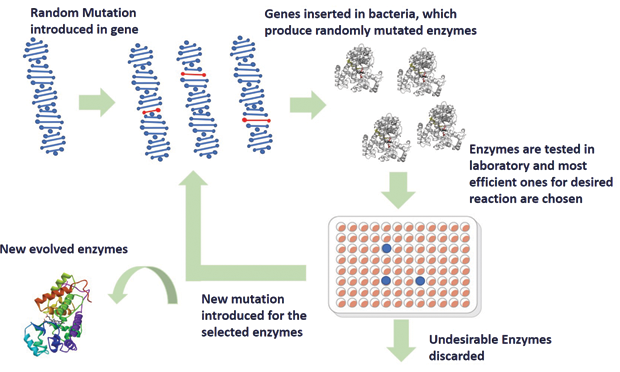
У основоположній роботі, опублікованій у 1993 році, Арнольд продемонстрував спрямовану еволюцію ферменту під назвою субтилізин Е. Субтилізин Е, що виник у еволюції, показав у 256 разів вищу активність у своєму неприродному середовищі, тобто в органічному розчиннику, порівняно з диким типом. Це був еталонний експеримент, який започаткував нову еру спрямованої еволюції ферментів, що зрештою призвело до створення кількох корисних біологічних систем, таких як ферменти з новими властивостями, новими метаболічними шляхами, відновлюване біопаливо та безпечний для навколишнього середовища хімічний синтез. Спрямована еволюція, на додаток до вдосконалення функції існуючих білків, дозволила створити нові ферменти з білковими функціями, для яких не існувало природного ферменту. Наприклад, фермент цитохрому P450, природною функцією якого є метаболізм, можна модифікувати для виконання абсолютно нової функції — природного введення атомів кисню в ліки, які ми приймаємо. Це дозволяє створювати екологічно чисті препарати та пестициди. Було також продемонстровано розроблені ферменти, які перетворюють цукор в ізобутанол, органічну сполуку, яку можна використовувати для екологічної альтернативи паливу та пластику. Техніка спрямованої еволюції успішно принесла нову хімію в біологічний світ з обіцянкою більш екологічного світу.
Маніпулювання фагами для адаптації антитіл
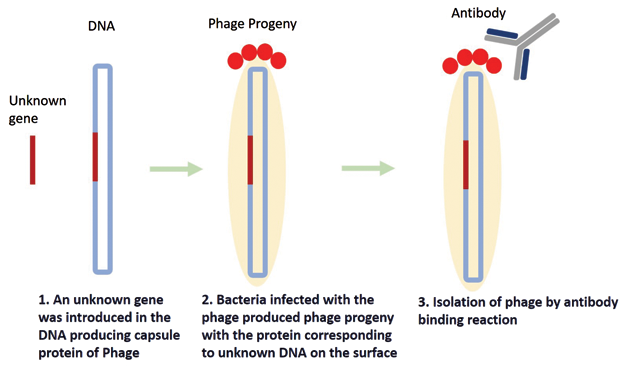
Фаги – це віруси, що складаються з генома ДНК або РНК, інкапсульованого білками. Фаги атакують бактерії, вводячи їх генетичний матеріал, який потім бере на себе метаболізм бактерій. Генетичний матеріал фага реплікується, а інкапсулюючий білок накопичується всередині бактерії. Потім бактерії екструдують кілька копій потомства фага. У 1985 році Сміт використав цей простий механізм фагів, щоб знайти невідомий ген для відомого білка. Він використав фрагмент невідомого гена та поєднав його з геном одного з білків фагової капсули ниткоподібного фага. Коли були отримані фаги-потомки, білок, відповідний невідомому гену, з'явився на поверхні фага разом з білком капсули. Цей процес відомий як «фаговий дисплей» (рис. 3). На наступному етапі, використовуючи відповідне антитіло, фаг, що несе цільовий білок, може бути виловлений. Таким чином, фаги діяли як сполучна ланка між генами та білками, і невідомі гени, відповідальні за експресію певного білка, можна було легко ідентифікувати.
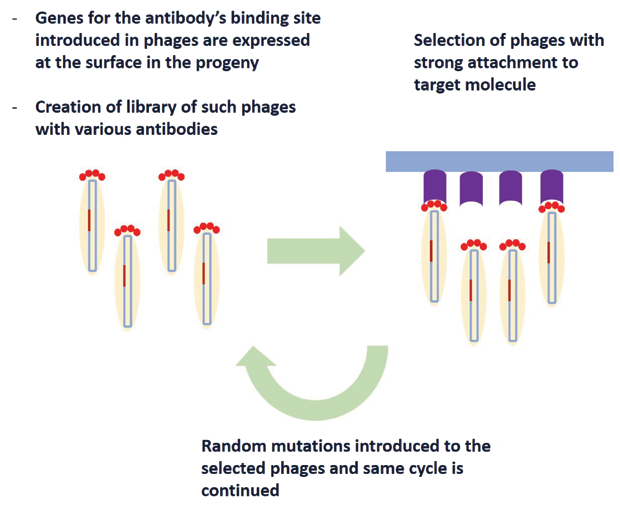
Прямим наслідком фагового дисплея є конструювання антитіл. Спочатку дослідники намагалися отримати антитіла до певного захворювання, вводячи мишам цільовий білок для цього конкретного захворювання. Кілька обмежень такого методу змусили Вінтера почати досліджувати потенціал фагового дисплея Сміта для створення антитіл, де ген, відповідальний за сайт зв’язування антитіла, поєднувався з генетичним матеріалом білка капсули фага. Це призвело до експресії сайту зв'язування антитіла на поверхні фага. Була створена бібліотека фагів з різними типами антитіл на їх поверхні, і антитіла, які приєднуються до цільової молекули, потім виловлюються з цієї бібліотеки. Потім вони піддаються випадковим мутаціям, утворюючи друге покоління фагів з антитілами на поверхні, які міцніше зв’язані з цільовою молекулою. Після кількох ітерацій згенеровані антитіла мали надзвичайно високий рівень специфічності до цільової молекули, метод, відомий як «спрямована еволюція антитіл». Рисунок 4 схематично демонструє цю базову концепцію. Демонстрація Вінтером фагового дисплея антитіл у 1990 році зробила революцію у фармацевтичній промисловості та призвела до створення білків, пептидів і антитіл із безмежними можливостями.
Як спрямована еволюція ферментів і антитіл призвела до пральних порошків і не тільки
Відкриття, які призвели до Нобелівської премії з хімії 2018 року, зробили революцію у сферах фармації, енергетики та хімічного синтезу. За останні кілька десятиліть спрямована Арнольдом еволюція ферментів і Сміт і Вінтер фаговий дисплей антитіл продемонстрували безпрецедентні можливості для більш зеленої та вільної від хвороб планети.
Спрямована Арнольдом еволюція ферментів була широко застосована у фармацевтичній промисловості для більш ефективного розробки ліків. Крім того, можливість адаптувати ферменти призвела до розробки біопалива — екологічнішої альтернативи невідновлюваним джерелам енергії. Спрямована еволюція також уможливила заміну традиційної хімії, яка часто передбачає використання токсичних хімікатів, на екологічно чисту альтернативу для виробництва добрив, промислових розчинників, миючих засобів тощо. Розвинені ферменти, які мають вищий рівень специфічності, вищу толерантність до різноманітних середовищ і обмежених надлишкових реакцій, уможливили відкриття нових реакцій, невідомих біологічному світу. Усвідомлюючи важливість цього методу, у 2005 році Арнольд став співзасновником Gevo, Inc., яка зосереджується на виробництві відновлюваних хімічних речовин і біопалива. За останні два десятиліття спрямована еволюція показала свій справжній потенціал, і ще належить побачити, які ще захоплюючі можливості вона відкриває в майбутньому.
Хоча спрямована еволюція ферментів залишила свій відбиток у хімічній та енергетичній промисловості, фаговий дисплей пептидів і антитіл здійснив революцію у фармацевтичній промисловості. Це призвело до розробки антитіл до різних захворювань, у тому числі раку. Щоб використати потенціал фагового дисплея для практичного застосування, Вінтер заснував компанію з виробництва антитіл під назвою Cambridge Antibody Technology. Дослідження Вінтера привели до відкриття препарату на основі людського антитіла під назвою HUMIRA, який може зупинити запалення в організмі. HUMIRA була схвалена в 2002 році для боротьби з ревматоїдним артритом і є першим у світі повністю людським антитілом. Успіх фагового дисплея антитіл у розробці першого людського антитіла спонукав фармацевтичну промисловість використовувати техніку для розробки антитіл проти раку. Було також продемонстровано ліки від метастатичного раку. Були схвалені антитіла для лікування сибірської виразки та аутоімунних захворювань, таких як вовчак. Багато інших зараз проходять клінічні випробування. Концепція фагового відображення антитіл обіцяє кілька інших проривів у галузі охорони здоров’я.
Відкриття Арнольда, Сміта та Вінтера знаменують нову еру у створенні білків на благо людства. Кілька останніх десятиліть неодноразово демонстрували через різноманітні застосування величезний технологічний вплив спрямованої еволюції ферментів і фагового дисплея антитіл, але це лише верхівка айсберга.









