Перспективи застосування токсинів зміїної отрути для лікування нейродегенеративних захворювань та знеболення. Частина 1.
Зло, як і отрути, має своє призначення. Є хвороби, які нічим іншим не вилікуєш
Томас Пейн
На нейродегенеративні захворювання страждають мільйони людей у світі. На жаль, специфічного хворобомодифікувального лікування для таких пацієнтів наразі немає, що робить пошук ефективних препаратів нагальною потребою. Нейродегенерацію спричиняє активація низки клітинних процесів, зокрема окисного стресу, порушень функцій мітохондрій, нейрозапалення, старіння, утворення білкових агрегатів, глутаматергічної ексайтотоксичності та апоптозу. Метою дослідницьких груп є виявлення речовин, які можуть пригнічувати одну або декілька з цих подій, що призводять до загибелі нейронних клітин. Тваринні отрути являють собою перспективні природні джерела нових молекул, які невпинно вдосконалювалися шляхом природного добору.
Багато природних пептидів, ідентифікованих в отрутах змій, скорпіонів, бджіл, павуків, молюсків тощо, зменшують запалення, регулюють вивільнення глутамату, змінюють рівень нейромедіаторів, блокують активацію іонних каналів, знижують концентрацію білкових агрегатів та підвищують нейропротекторні фактори. Ці компоненти здатні потенційно уповільнювати або навіть припиняти нейродегенерацію, застосовуються для лікування широкого спектра нейродегенеративних станів, зок¬рема хвороб Альцгеймера (ХА) й Паркінсона (ХП), ішемії мозку, глаукоми, бічного аміотрофічного (БАС) та розсіяного склерозу, а також місцевої терапії невралгій, нейрозапальних захворювань, радикулітів, люмбаго тощо.
Механізми нейродегенерації
Нейродегенерація є основною причиною розвитку багатьох неврологічних патологій, як-от ХА, ХП, хвороба Гентінгтона та ішемія головного мозку (Kalogeris et al., 2012). Патологічні механізми, що лежать в їх основі, характеризуються порушенням структури тканин і клітинних функцій в окремих уразливих нейронних системах, що може поступово спричинити виникнення таких станів, як (Yan et al., 2013):
- когнітивна дисфункція;
- моторний дефіцит;
- психічні розлади.
Незважаючи на зусилля дослідників, складність процесів загибелі клітин і визначення етіології захворювань створюють багато перешкод для повного розуміння їх природи та розробки методів лікування, здатних модифікувати перебіг патологій.
Причинами загибелі нейронів можуть бути апоптоз, некроз та автофагія. Незважаючи на відмінності, ці механізми клітинної смерті співіснують і мають деякі спільні риси. Також у розвитку низки нейродегенеративних захворювань вирішальну роль відіграє ексайтотоксичність. На жаль, внутрішньоклітинні механізми, відповідальні за цей тип загибелі нейронних клітин, наразі ще повністю не з’ясовані. Надмірна активація нейронів збудливими нейромедіаторами, такими як глутамат, вважається основною причиною ексайтотоксичного пошкодження мозку (Quillinan et al., 2016).
Гострі ураження ЦНС, як-то ішемія та черепно-мозкова травма, викликають інтенсивне вивільнення глутамату, що призводить до надмірної стимуляції глутаматних рецепторів і масивного припливу іонів, зокрема Ca2+. Порушення іонної рівноваги деполяризує потенціал плазматичної мембрани та знижує внутрішньоклітинний рН (Surin et al., 2014). Надмірна активація АТФ-залежних іонних насосів, спрямована на відновлення іонного гомеостазу, спричиняє виснаження АТФ і енергетичний стрес (Mukherjee et al., 2008). Механізми, залучені до метаболічної відповіді нейронів на екс-айтотоксичність, є вельми складними і відіграють фундаментальну роль у здатності нейрона адаптуватися та відновлюватися після такого руйнівного впливу.
Нейрони значно більш сприйнятливі до метаболічного стресу, викликаного ексайтотоксичними процесами. Ці події можуть призвести до збільшення вмісту активних форм кисню (АФК) (Vergun et al., 2003). Хоча АФК є важливими внутрішньоклітинними сигнальними молекулами, у високих концентраціях вони можуть бути цитотоксичними, що призводить до окисного стресу та, як наслідок, – пошкод¬жен¬ня структури ДНК, руйнування клітинної мембрани, зміни структури й функцій білків через їх окиснення (Gandhi, Abramov, 2012).
Підвищений вміст АФК було виявлено при вивченні посмертних зразків тканин мозку осіб із нейродегенеративними розладами, зокрема ХП, ХА та БАС (Yan et al., 2013; Zuo et al., 2015; Pedersen et al., 1998). Також АФК-залежні зміни в метаболізмі білків збільшують вміст нерозчинних агрегатів або накопичення протофібрил за патологічних умов, що спричиняє нейро-дегенерацію (Horiguchi et al., 2003).
Навіть за відсутності окисного стресу деякі білки з неправильною тривимірною структурою здатні викликати токсичність, і це спричиняє загибель клітин. Неправильно згорнутий білок також може секретуватися в позаклітинний простір, що призводить до формування позаклітинних бляшок (Friedrich et al., 2010). Дослідження показали, що в міру старіння організм поступово втрачає деякі механізми, пов’язані з запобіганням накопиченню помилково згорнутих білків (Kirstein-Miles, Morimoto, 2010). Однак межа між патологічною нейродегенерацією та нормальними змінами при старінні не є чіткою.
Власне, однозначно визнано, що старіння викликає нейродегенерацію, оскільки пов’язане з порушенням білкового гомеостазу, що зумовлює:
- розвиток агрегатів і тілець включення;
- пошкодження ДНК;
- лізосомну дисфункцію;
- епігенетичні зміни;
- імунну дисрегуляцію.
Незважаючи на всі набуті знання, шкідливі події, внаслідок яких відбувається загибель нейронних клітин, ще не до кінця вивчені. Розкриття механізмів, що лежать в основі нейродегенерації, може допомогти розробити альтернативні підходи для припинення розвитку таких пошкоджень (de Souza et al., 2018).
Токсини зміїної отрути для лікування нейродегенеративних захворювань.
Хвороба Альцгеймера
Хвороба Альцгеймерає причиною 60 80% випадків деменції та переважно вражає осіб віком від 65 років, що призводить до смерті приблизно через 7 10 років від дебюту симптомів (Plassman et al., 2007). Хвороба Альцгеймера характеризується тяжкою атрофією мозку і прогресувальною загибеллю нейронів, що спричиняє серйозні проблеми із пам’яттю, поведінкові зміни, мовленнєві порушення, дефіцит уваги та загальне зниження когнітивних функцій (Holtzman et al., 2011).
Нині препаратами для лікування пацієнтів із хворобою Альцгеймера, які схвалені Управлінням з контролю за якістю харчових продуктів і медикаментів США (FDA), є антагоніст NMDA-рецепторів мемантин та інгібітори ацетилхолінестерази (АХЕ), які дещо зменшують холінергічний дефіцит. Проте жоден із них не затримує прогресування захворювання. Розробка нових молекул, спрямованих на різні аспекти патології, з використанням природних токсинів може бути перспективним підходом, якщо брати до уваги їх селективність дії щодо різних ферментів, каналів і субодиниць (таблиця).
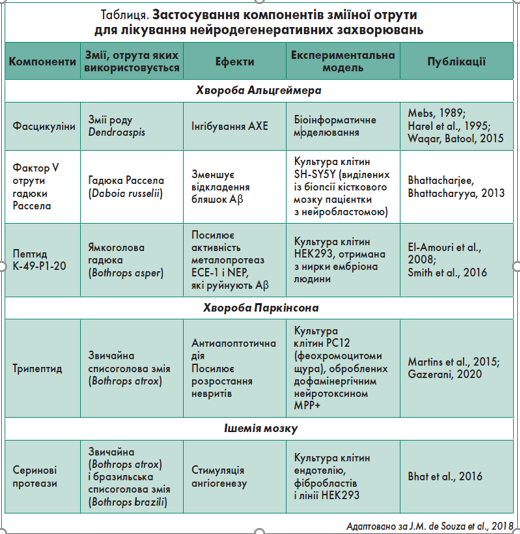
Токсини, отримані зі зміїної отрути, широко досліджувалися для потенційного терапевтичного застосування при хворобі Альцгеймера та інших патологіях. Як відомо, вони можуть бути корисними для зменшення дефіциту ацетилхоліну при таких захворюваннях, як хвороба Альцгеймера. Нещодавно зусилля вчених привели до виявлення токсинів із потенційною інгібіторною активністю щодо АХЕ (Waqar, Batool, 2015).
Гадюка Рассела (Daboia russelli) виробляє отруту, що містить багато ізоформ фосфоліпази А2, ферменти-прокоагулянти (активатори факторів X і V), геморагіни, нуклеази, протеази, гіалуронідази та інші сполуки. Наявні дані, що фактор V отрути цієї гадюки дестабілізує агрегати β-амілоїду (Aβ) в in vitro культурах клітин SH-SY5Y людини, інкубованих із пептидами Aβ42/Aβ40 (Bhattacharjee, Bhattacharyya, 2013). Також він захищає клітини від токсичності, спричиненої Aβ. Подальші дослід¬жен¬ня з використанням даних пептидів можуть мати потенціал для розробки нових терапевтичних засобів (Van Dam, De Deyn, 2006).
Металопротеази відіграють важливу роль у регуляції багатьох фізіологічних процесів. Результатом активності металопротеаз ECE 1 і NEP є руйнування Aβ у мозку. Своєю чергою для її стимуляції використовують поліфеноли зеленого чаю і кінуренову кислоту (Klein et al., 2013). Вважається, що посилена активність ECE 1 і NEP чинить сприятливий вплив проти хвороби Альцгеймера, – це продемонстровано їх генетично індукованою підвищеною експресією на трансгенних мишачих моделях (El-Amouri et al., 2008).
Також вчені виявили пептид K 49-¬P1 20, що міститься у структурі міотоксину 2, гомолога фосфоліпази А2 з отрути ямкоголової гадюки (Bothrops asper). Було доведено його ефективність для стимуляції активності ECE 1 і NEP. До того ж стало відомо, що за наявності пептиду K 49-P1 20 інтенсивність розщеплення ендогенного Aβ40 у спинномозковій рідині суб’єкта з хворобою Альцгеймера металопротеазою ECE 1 збільшується, що підтверджує його потенційну роль для лікування цієї патології (Smith et al., 2016).
Хвороба Паркінсона
Хвороба Паркінсона є другим за поширеністю нейродегенеративним захворюванням, на яке страждають переважно люди віком від 55 років. Хвороба Паркінсона характеризується прогресувальною нейродегенерацією компактної частини чорної речовини, що зазвичай вражає дофамінергічні нейрони. Нейродегенерація є безпосередньою причиною симптомів хвороби Паркінсона, які включають брадикінезію, тремор спокою та ригідність (George et al., 2009). Окрім рухових змін, в осіб із ХП можливий розвиток когнітивних порушень та психіатричних розладів (Beitz, 2014).
Дослідження зміїної отрути як терапевтичного засобу для лікування хвороби Паркінсона проводили на клітинах PC12 (отриманих із феохромоцитоми щура), оброблених дофамінергічним нейротоксином MPP+, що викликає симптоми хвороби Паркінсона. Було показано, що нейропротекторна активність і здатність індукувати нейритогенез притаманна пептиду, виділеному із фракції Ba-IV отрути звичайної списоголової змії (Bothrops atrox). Цей пептид може значно зменшувати загибель клітин, а його захисний ефект пов’язаний зі зниженням активності каспази 9/-3. Крім того, у даній клітинній моделі хвороби Паркінсона після обробки пептидом спостерігався ріст нейритів. Це означає, що основний протективний механізм може включати нейротрофічний ефект (Gazerani, 2020).









